Le wakame (Undaria pinnatifida) 



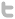
-

X Faire un lien vers cette page :
CTRL + C pour copier




- Vous êtes ici :
- www.observatoire-biodiversite-bretagne.fr
- >
- espèces invasives
- >
- Faune et flore marines
- >
- Flore marine
- >
- Le wakame (Undaria pinnatifida)

http://www.observatoire-biodiversite-bretagne.fr/especes-invasives/Faune-et-flore-marines/Flore-marine/Le-wakame-Undaria-pinnatifida
Dernière modification le 05 mai 2008
Le wakame (Undaria pinnatifida)
Originaire d’Asie, Undaria pinnatifida, (Harvey) Suringar, 1873, connue également sous le nom de wakame, a connu une expansion mondiale depuis les années 1970. En Europe, comme dans son aire d’origine, U. pinnatifida est une espèce présente sous forme de cultures (sur filières) et de populations spontanées. Cette algue colonise des structures artificielles (ports, digues, etc.) mais également le milieu naturel rocheux. Sa tolérance aux conditions du milieu, sa capacité à coloniser des habitats perturbés ou des substrats vierges et un stade microscopique dans son cycle de vie en font une espèce pionnière efficace.
Sommaire
A. Description, écologie, origine et répartition
Le wakame est une algue cultivée, introduite depuis une trentaine d’année en Europe. Ses caractéristiques morphologiques, reproductives et sa tolérance aux conditions du milieu en font une espèce colonisatrice efficace.
Description
Undaria pinnatifida, appelé wakame, est une grande algue brune de l’ordre des laminariales, qui mesure environ 1 et 2 mètres (Cabioc’h et al. 1992). Le wakame est fixé au fond par un crampon (organe de fixation, mais pas d'assimilation des nutriments à l’inverse des racines des plantes terrestres), qui se prolongent par un stipe autour duquel se développe une lame fine et ondulée (le thalle). La lame est très caractéristique avec une sorte de nervure centrale (qui n’est pas assimilable à une nervure de feuilles). Lorsque l’algue devient fertile, des sporophylles (nom donné aux structures de reproduction) se développent au niveau de la base du stipe formant des falbalas.
Ecologie
Undaria pinnatifida est une algue des eaux tempérées froides qui colonise la zone supérieure de l’infra-littoral, le plus souvent dans des sites caractérisés par de forts courants mais non battus (c’est-à-dire en dehors des zones de déferlement des vagues). Elle ne supporte pas des périodes d’exondations trop longues. Selon la turbidité, elle peut s’installer en zone subtidale jusqu’à une quinzaine de mètres de profondeur.
Le wakame se fixe sur toute sorte de substrats solides qu’ils soient naturels (rochers) ou artificiels (infrastructures portuaires, coques de bateaux, filières, corps-morts etc.). Cette facilité à coloniser des habitats variés est une des explications de son succès d’introduction.
Le wakame présente dans son aire d’origine et dans son aire d’introduction une grande tolérance vis-à-vis des conditions du milieu en termes de température, salinité et pollutions organiques. Ceci expliquerait en partie sa large distribution géographique en Europe (de la Méditerranée à la Mer du Nord ; Wallentinus 2007). En Bretagne, la température optimale de recrutement de sporophytes est autour de 13 à 17°C et la plupart des populations sont trouvées à des salinités supérieures à 30 psu (1) . La phase gamétophytique pourrait être particulièrement résistante aux conditions du milieu, notamment à la température (Stuart, 1999).
Reproduction
Undaria pinnatifida est une algue annuelle présentant un cycle de reproduction sexuée caractérisé par une alternance entre des stades haploïdes (appelé gamétophytes) et diploïdes (appelés sporophytes).
Les sporophytes sont la phase visible (macroscopique) du cycle alors que la phase gamétophyte est microscopique (non visible à l’œil nu). Le sporophyte se développe en quelques semaines et vit quelques mois. Arrivé à maturité, il libère des spores dans la colonne d’eau puis meurt. Les spores qui ne vivent que quelques heures à quelques jours se fixent et germent pour se développer en gamétophytes mâles ou femelles. Les gamétophytes mâles libèrent des gamètes mâles qui se déplacent jusqu’au gamétophyte femelle producteur de gamètes femelles qu’ils fécondent. Le jeune sporophyte issu de cette fécondation se développe ainsi sur le gamétophyte femelle.
La reproduction asexuée a également été décrite mais en laboratoire (Fang et al., 1982) et est utilisée pour de la culture en masse dans la zone d’origine de l’algue (Wu et al. 2004).
La lumière, la profondeur et surtout la température sont très importantes pour déclencher le phénomène de reproduction chez U. pinnatifida. En Bretagne, en général deux générations par an sont observées (Castric et al. 1999, Voisin 2007). Des sporophytes reproducteurs sont observables quasiment toute l’année dans des populations denses (ex. en milieu portuaire). La majorité des nouveaux sporophytes est observée à des températures entre 13° et 17°C (Castric-Fey et al., 1999).
Plusieurs stades de dispersion naturelle existent ainsi chez cette algue : des spores, des gamètes mâles et des thalles mâtures (sporophytes avec sporophylles) dérivants qui peuvent relâcher des spores sur de longues distances. Ces trois stades peuvent se disperser dans la colonne d’eau en fonction des courants. Les gamétophytes sont quant à eux fixés.
Modalités d'introduction et répartition
La première observation d’Undaria pinnatifida en dehors de son aire d’origine a été faite dans l’étang de Thau, point initial de son introduction en Europe. Elle y fut introduite accidentellement, suite à l’importation de naissains de l’huître japonaise Crassostrea gigas (Perez et al. 1981). Des populations ont ensuite été signalées en 1984 en dehors de l’étang de Thau, sur les côtes de la Méditerranée (Perez et al. 1990). A partir de 1983, des populations ont été transférées volontairement pour des essais de mises en culture, sur les îles d’Ouessant, de Sein et de Groix ainsi que dans l’estuaire de la Rance (Perez et al. 1984). En parallèle de sa mise en culture, des populations spontanées ont été rapidement signalées de l’île de Ouessant aux Pays bas (Floch’h et al. 1991) ainsi que sur les côtes anglaises (Fletcher et Manfredi, 1995).
Aujourd’hui, U. pinnatifida est présente le long des côtes de la Mer du Nord, de la Manche, de l’Atlantique (Grande-Bretagne, Pays-Bas, Belgique, France et Espagne) et en Méditerranée. Elle y occupe des habitats naturels rocheux, des zones portuaires ou différentes structures artificielles et est toujours cultivée (en Bretagne et en Espagne). L’Europe n’est pas le seul point d’introduction de wakame. Elle s’est installée de façon durable dans les deux hémisphères et dans la plupart des océans du globe. Ainsi des introductions de cette algue ont eu lieu en Australie et Nouvelle Zélande au milieu des années 80, en Californie en 2001, au Mexique en 2003 et en Argentine à la fin des années 90 et a atteint la Patagonie en 2009 (Wallentinus, 2007). Sur l’ensemble de son aire de distribution actuelle, elle a bénéficié de multiples vecteurs d’introduction parmi lesquels le navire maritime et l’aquaculture ont joué un rôle important (Voisin et al. 2005).
Les caractéristiques biologiques du wakame lui donnent la capacité de coloniser de multiples substrats naturels ou artificiels, en particulier dans des environnements perturbés, occupés ou pas par d’autres espèces.
Capacité de colonisation
De nombreuses caractéristiques biologiques ou relatifs à l’histoire de son introduction (Fletcher et Farrell 1999, Castric et al. 1999 ; Voisin et al. 2005) explique le succès d’installation de cette algue classée par Nyberg et Wallentinus (2005) au troisième rang des espèces les plus menaçantes parmi 113 autres espèces d’algues.
Parmi ses caractéristiques qui ont pu favoriser son développement, on peut noter :
- des introductions répétées et en provenance de multiples sources (comme le fouling sur les coques des navires, l’aquaculture), associées à de nombreux vecteurs naturels de dispersion (comme les spores, les thalles dérivants),
- peu de prédateurs sur nos côtes (Castric-Fey et al., 1997) ;
- la présence de phases microscopiques dans son cycle de vie (ex. gamétophytes),
- des caractéristiques d’espèces pionnières lui permettant de coloniser rapidement de nouveaux substrats vierges ou des environnements perturbés,
- sa capacité à s’installer sur une très large gamme de substrats tels que des rochers, des structures artificielles (bouée, corps-morts, pontons, coques etc.) d’autres espèces (le wakame est par exemple trouvé en épiphyte sur une autre espèce introduite, l’ascidie japonaise Styela clava),
- ses taux de croissance rapide conduisant à une canopée de grande taille, ainsi que sa dynamique de reproduction efficace, avec l’émission de spores quasiment toute l’année et des gamétophytes certainement capables de rentrer en dormance.
Impacts
Impacts écologiques
Différents travaux de recherches ont montré que l’établissement d’Undaria pinnatifida est facilité dans des habitats dépourvus de canopée ou perturbés, dans lesquels elle peut devenir une algue dominante. Cependant, en Bretagne, elle semble être moins compétitive que d’autres espèces locales comme l’espèce opportuniste Saccorhiza polyschides (Castric-Fey et al. 1993). Il a également été suggéré que le broutage des sporophytes et gamétophytes par des oursins (Paracentrotus lividus, Echinus esculentus et Psammechinus miliaris) et des ormeaux, Haliotis tuberculata, pourraient avoir un effet négatif sur l’abondance de Undaria pinnatifida (Floc.h et al. 1991; Castric-Fey et al. 1993). Sur les côtes anglaises de la Manche, aucun impact écologique négatif n’a pu être mis en évidence en milieu rocheux et il a été suggéré que la présence de wakame pouvait être positive pour l’établissement de nurserie pour certains poissons (Fletcher et Farrell 1999). En revanche, dans les marinas et ports, elle pourrait remplacer des espèces natives.
Impacts économiques
Plusieurs activités et notamment l’aquaculture sont gênées dans les secteurs de forte prolifération du wakame. Celui-ci peut devenir problématique en créant :
- une charge de travail et de coup supplémentaires pour entretenir les installations aquacoles colonisées : colmatage des bouchots, alourdissement des filières, encrassement des machines d’exploitation, encombrement des casiers à filets, etc.,
- une compétition vis-à-vis des espèces cultivées ; lorsque la colonisation est très importante, l’écoulement de l’eau à travers les poches ou les casiers peut être restreint et ainsi ralentir le développement des espèces cultivées,
- une invasion des pontons et des structures portuaires formant une canopée dense responsable d’un « fouling » important.
Undaria pinnatifida présente une phase microscopique au cours de son cycle de vie qui rend particulièrement problématique la gestion des populations présentes sur nos côtes.
Il apparait que non seulement Undaria pinnatifida a colonisé nos côtes, mais s’y est aussi très bien adaptée. Aucune méthode satisfaisante curative (visant à éliminer l’espèce localement) n’existe.
La prévention visant à empêcher sa dissémination dans le milieu naturel est essentielle. Il existe un règlement du Conseil Européen (No 708/2007 du Conseil du 11 juin 2007) qui établit un cadre concernant les pratiques aquacoles relatives aux espèces exotiques.
La prévention
Malgré de faibles capacités de dispersion naturelle, la dispersion d’origine anthropique a permis à Undaria pinnatifida de coloniser de nombreux secteurs. La vigilance doit porter sur les vecteurs de dispersion (eaux de ballast, coquilles de bivalves, coques de bateaux, bouées…).
Les coques des bateaux de plaisance colonisées par du wakame ne doivent pas être nettoyées dans l’eau et les algues enlevées doivent être déposées dans des containers.
Dans les zones où cette espèce est absente, les restes de sporophylles mâtures présents sur les filières de cultures devraient être enlevés et ramenés à terre afin d’éviter la dissémination de spores dans les habitats naturels environnants. De même, dans ces zones, elle ne devrait pas être utilisée dans des aquariums en absence de traitements de rejets (ex. lors de démonstrations publiques ou dans des écoles).
La valorisation
Les qualités alimentaires et pharmaceutiques du wakame en font une algue à forte valeur commerciale. Elle est ainsi la troisième algue cultivée ou récoltée à une échelle mondiale pour l’alimentation humaine. Elle est également utilisée pour nourrir les ormeaux en élevage en Asie. En Bretagne, Undaria pinnatifida est cultivée notamment en rade de St-Malo et en baie de Morlaix (Wallentinus, 2007).
Lutte biologique
Aucune méthode de lutte biologique n’est répertoriée comme efficace sur cette algue. Cependant, elle semble être exploitée par de nombreux herbivores (voir « Impacts écologiques »). De plus, elle est colonisée par de nombreuses ascidies coloniales (de type Botryllus sp.), bryozoaires et hydraires (Wallentinus 2007) qui pourraient accélérer la dégénérescence de la lame des sporophytes.
Lutte mécanique
L’arrachage est pratiqué dans le cadre de la lutte mécanique. L’arrachage pour cette espèce se révèle souvent très fastidieux et très peu efficace du fait d’une recolonisation rapide des zones nettoyées (Hewitt et al. 2005). Par exemple, sur les côtes anglaises, lors de l’apparition de wakame, tous les sporophytes visibles ont été enlevés mais cette tentative d’éradication a échoué car les algues étaient déjà fertiles et des gamétophytes microscopiques étaient déjà certainement présents dans le milieu (Fletcher et Farrell 1999).
Lutte chimique
Le traitement avec des herbicides et des peintures antifouling a révélé que certaines toxines sont efficaces en prévention de la germination des spores ou pour détruire les gamétophytes (Wallentinus 2007). Ce type de traitement peut toutefois avoir des conséquences très néfastes sur l’écosystème.
Le wakame est étudié sur les côtes françaises depuis une trentaine d’années. Afin de mieux la cerner, elle fait l’objet de nombreux suivis, notamment en Bretagne.
Undaria pinnatifida a fait l’objet de différents suivis et programmes de recherches en Bretagne menés notamment par les stations de biologie marine de Concarneau et Roscoff.
Ainsi dans le cadre du programme REBENT (http://www.rebent.org/documents/index.php), S. Derrien-Courtel et ses collaborateurs ont mené une série d’observations et de suivis en milieu subtidal rocheux est menée, comprenant l’observation d’espèces remarquables parmi lesquels des espèces exotiques, comme Undaria pinnatifida.
Undaria pinnatifida a été étudiée avec d’autres grandes algues de Bretagne, dans le cadre du programme ANR ECOKELP (resp. M. Valero, http://www.sb-roscoff.fr/ecokelp/ ) dont l’objectif principal était l’étude de la dynamique de la biodiversité et de la "valeur" économique et sociale des laminaires.
Dans le cadre de ce projet, des suivis et études génétiques ont été effectués pour analyser la dynamique de reproduction et d’installation des populations de wakame dans les zones portuaires et naturelles (thèses de Marie Voisin en 2007 et de Daphné Grulois toujours en cours en 2010).
Aujourd’hui, le wakame est une des espèces cible du WP 3 (resp. J. Bishop, Plymouth & F. Viard, Roscoff), dans le cadre du programme INTERREG Marinexus. Il s’agit ici de mieux appréhender le rôle des installations portuaires sur la biodiversité et la connectivité des populations de différentes espèces exotiques.
Différentes actions de recherche sont nécessaires chez cette espèce, notamment concernant ses capacités d’adaptation à long terme et son impact sur le milieu 30 ans après son introduction initiale en Bretagne. Les suivis sur le terrain sont à pérenniser sur le long terme pour mieux appréhender le devenir de cette espèce et l’évolution de sa distribution géographique à une échelle régionale.
Rédigé par Julie Pagny (GIP BE) en collaboration avec Frédérique Viard (Station biologique de Roscoff).
E. Références
Cabioc’h J., Floc’h J.-Y. , Le Toquin A. , Boudouresque C. F. ,Meinesz A. & Verlaque M., 1992. Guide des algues des Mers d’Europe , Delachaux et Niestlé, Neuchâtel, Paris.
Castric-Fey A., Beaupoil C., Bouchain J., Pradier E. & L'Hardy-Halos M. T., 1999. "The introduced alga Undaria pinnatifida (Laminariales, Alariaceae) in the rocky shore ecosystem of the St-Malo area: growth rate and longevity of the sporophyte." Botanica Marina 42: 83-96.
Castric-Fey A., Beaupoil C., Bouchain J., Pradier E. & L'Hardy-Halos M. T., 1999. "The introduced alga Undaria pinnatifida (Laminariales, Alariaceae) in the rocky shore ecosystem of the St-Malo area: morphology and growth of the sporophyte." Botanica Marina 42: 71-82.
Castric-Fey A., .L’Hardy-Halos M.Th and J. BOUCHAIN, 1997. Control of the Undaria pinnatifida population by the gastropods Gibbula ssp on the shore, in the Saint-Malo area. Aquatic life-cycle strategies, Survival in a variable environment. Plymouth, 14-17 avril 1997. Session IV « population and community », Poster sessions.
Castric-Fey A., Girard A. & L'Hardy-Halos M. T., 1993. "The distribution of Undaria pinnatifida (Phaephyceae, Laminariales) on the coast of St Malo (Brittany, France)." Botanica Marina 36: 351-358.
Fang. T. C., Dai, J., and Chen, D. 1982. Parthenogenesis and the genetic properties of parthenosporophytes of Undaria pinnatifida. Acta Oceanologica Sinica, 1: 107–111.
Fletcher R. L. & Farrell P., 1999. "Introduced brown algae in the North East Atlantic, with particular respect to Undaria pinnatifida (Harvay) Suringar." Helgoländer Meeresuntersuchungen 52: 259-275.
Fletcher R. L. & Manfredi C., 1995. "The occurence of Undaria pinnatifida (Phaeophyceae, Laminariales) on the south coast of England." Botanica Marina 38: 355-358.
Floc'h J. Y., Pajot R. & Mouret V., 1996. "Undaria pinnatifida (Laminariales, phaeophyta) 12 years after its introduction into the Atlantic ocean." Hydrobiologia 326/327: 217-222.
Floc'h J.-Y., Pajot R. & Wallentinus I., 1991. "The japanese brown alga Undaria pinnatifida on the coast of France and its possible establishment in european waters." J. Cons. int. Explor. Mer 47: 379-390.
Hewitt C. L., Campbell M. L. , McEnnulty F., Moore K. M., Murfet N. B., Robertson B. & Schaffelke B., 2005. "Efficacy of physical removal of a marine pest: the introduced kelp Undaria pinnatifida in a Tasmanian Marine Reserve." Biological Invasions 7: 251–263.
Nyberg C. D. & Wallentinius I., 2005. "Can species traits be used to predict marine macroalgal introductions?" Biological Invasions 7: 265-279.
Peréz R., Lee J. Y. & Juge C., 1981. Observations sur la biologie de l’algue japonaise Undaria pinnatifida (Harvey) Suringar introduite accidentellement dans l’Etang de Thau.Science et Pêche, 315: 1 –12.
Perez R., Kaas R., Barbaroux O., 1984. Culture expérimentale de l'algue Undaria pinnatifida sur les côtes de France. Science et Pêche, Bull Inst Pêches marit 343.
Perez R., Kaas R., Barbaroux O., Arbault S., Le Bayon N., Moigne J.Y., 1990. Technique de culture pour les côtes bretonnes de l'algue alimentaire Undaria pinnatifida -Tableau de marche - étude économique- ArchiMer, Institutional Archive of Ifremer (French Research Institute for Exploitation of the Sea), p 1-68.
Saito Y., 1972. On the effects of environmental factors on morphological characteristics of Undaria pinnatifida and the breeding of hybrids in the genus Undaria. In: Abbott A, Kurogi M (eds) Contribution to the Systematics of the Benthic Marine Algae of the North Pacific. Jap. Soc. Phycol., Kobe, p 117-132.
Silva P. C., Woodfield R. A., Cohen A. N., Harris L. H. & Goddard J. H. R., 2002. "First report of the Asian kelp Undaria pinnatifida in the northeastern Pacific Ocean." Biological Invasions 4: 333-338.
Stuart M. D., Hurd C. L. & Brown M. T., 1999. "Effects of seasonal growth rate on morphological variation of Undaria pinnatifida (Alariaceae, Phaeophyceae)." Hydrobiologia 398/399: 191-199.
Voisin M., Engel C., Viard F., 2005. Differential shuffling of native genetic diversity across introduced regions in a brown alga: aquaculture vs. maritime traffic effects. Proceedings of the National Academy of Sciences, USA, 102 (15): 5432-5437.
Voisin M., 2007. Les processus d’invasions biologiques en milieu côtier marin : le cas de l’algue brune Undaria pinnatifida, cultivée et introduite à l’échelle mondiale. Thèse, Université Pierre & Marie Curie, Paris, 269 pages.
Voisin M., Daguin C., Engel C., Grulois D., Javanaud C. & Viard F., 2007. Processus et dynamique d’installation des espèces introduites en milieu marin : une illustration avec l’algue brune asiatique Undaria pinnatifida. Journal de la Société de Biologie, 201(3)
Wallentinus I., 2007. Alien species alert: Undaria pinnatifida (wakame or Japanese kelp). ICES COOPERATIVE RESEARCH REPORT, n° 283. 40 pages.
Wu C. Y., Li D. P., Liu H. H., Peng G. & Liu J. X., 2004. Mass culture of Undaria gametophyte clones and their use in sporeling culture. Hydrobiologia, 512 (1–3): 153–156.


X Partager sur les réseaux sociaux :